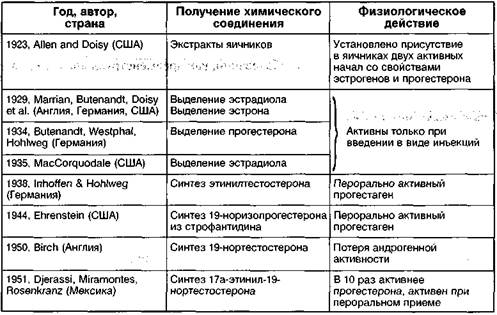
Таблица 1 Этапы эволюции репродуктивной эндокринологии
256 Эндокринная гинекология
Эстрогенычасто образно называют «гормонами молодости», «гормонами красоты и положительных эмоций» и, соответственно, снижение содержания эстрогенов в женском организме, развивающееся в результате истощения яичников, их возрастного увядания или удаления, приводит к ряду трофических и метаболических изменений, характеризующих в значительной степени процесс старения организма женщины (Манухин И.Б. и соавт., 2001; Yen S.S.C. et al., 1999).
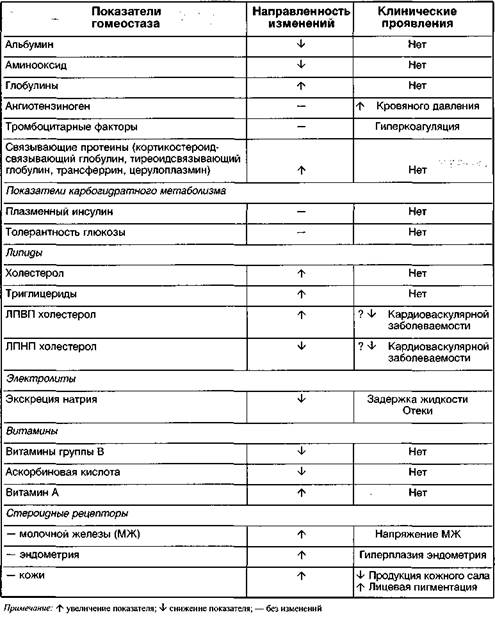
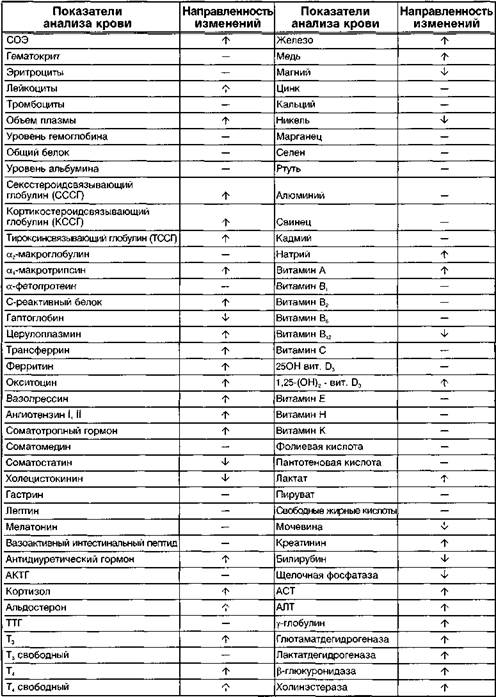
Системные эффекты эстрогенов, применяемые в заместительной гормональной терапии (ЗГТ), детально изложены в разделе патологии климактерического периода. Там же определены принципы дифференциального подхода к применению эстрогенов. Системное действие синтетических эстрогенов, применяемых в комбинированных оральных контрацептивах (КОК), отражено в таблицах 2 и 3. Представленные данные, по нашему мнению, могут быть полезны клиницисту при оценке тех или иных лабораторных исследований у женщин, применяющих КОК.
Что касается прогестерона,то само название гормона второй фазы менструального цикла обеспечивает его основное предназначение: прогестерон — «pro gesta-tio», т.е. «для беременности». Так, дефицит прогестерона зачастую имеет место при бесплодии и невынашивании, и, соответственно, именно эти патологические состояния в первую очередь являются показанием к применению прогестагенов.
Известно также, что эстрогены обеспечивают процесс пролиферации эндометрия, а прогестерон — его секрецию в ходе подготовки к имплантации оплодотворенной яйцеклетки. Таким образом, относительный или абсолютный дефицит прогестерона обуславливает развитие гиперпролиферативных процессов эндометрия. Именно гиперпластические процессы эндометрия, а также состояния с высоким риском их развития являются второй по значимости группой показаний к применению прогестагенов.
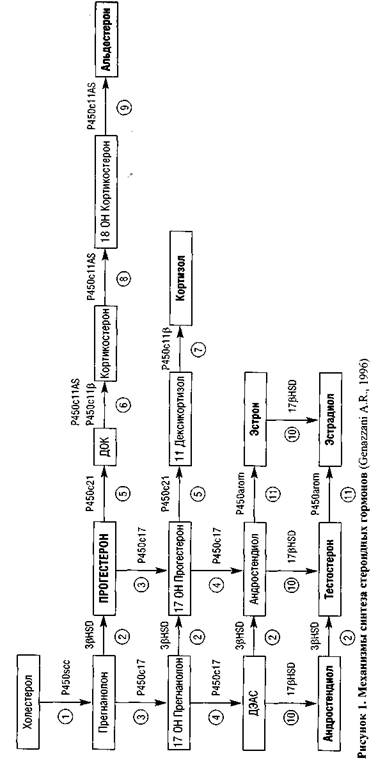
Изучение особенностей стероидогенеза в яичниках и метаболизма половых стероидов в организме (рис. 1), а также открытие стероидпродуцирую-щей функции глии и обмена нейростероидов в мозге обусловило применение прогестагенов в лечении таких заболеваний, как предменструальный синдром (ПМС), дисменорея и др. (Brain, 1996).
Таким образом, сегодня сформулированы основные показания к применению прогестагенов в гинекологической практике:
• Невынашивание беременности, бесплодие (особенно при недостаточности II фазы менструального цикла)
• Гиперпластические процессы эндометрия
• Протекторное воздействие на эндометрий при заместительной гормональной терапии
• Профилактика «синдрома вспышки» при применении агонистов ГнРГ (по данным литературы отмечается в 10-15% случаев за счет кратковременного повышения уровня эстрогенов на 10-12-й день после 1-ой инъекции агониста
Глава 14. Принципы применения половых стероидных гормонов. 257
и проявляется в виде межменструалъных кровянистых выделений или некоторого усиления болей при эндометриозе)
• Некоторые виды дисгормональных заболеваний молочных желез (ДЗМЖ)
Таблица 2 Метаболические эффекты этинилэстрадиола в дозах, применяемых в современных КОК
58 Эндокринная гинекология
Таблица 3 Изменение некоторых клинико-биохимических показателей на фоне применения КОК
Примечание: I s возрастает; ^ слегка возрастает; Ф снижается; v* слегка снижается; — без изменений
Глава 14. Принципы применения половых стероидных гормонов. 259
 260Эндокринная гинекология
260Эндокринная гинекология
Наличие в арсенале врача достаточно большого выбора препаратов, обладающих прогестагенным действием, но несколько разнящихся как химической структурой, так и особенностями биологических эффектов, предопределяет необходимость разработки принципов дифференцированного подхода к выбору конкретного препарата при той или иной патологии с учетом индивидуальных особенностей организма каждой конкретной женщины.
Спектр прогестагенов, применяющихся сегодня в клинической практике, включает природные и синтетические препараты (табл. 4).
Прогестагены, применяемые в гинекологической практике
| Натуральный прогестерон — для парентерального применения (мази, гели, инъекции) — для перорального применения (микронизированный — Утрожестан) | |
| Синтетические прогестагены | |
| Структурно сходные прогестерону Преанановые производные Ацетилированные: — медроксипрогестерона ацетат — мегестрола ацетат — ципротерона ацетат — хлормадинона ацетат — иедрогестон Неацетил ированные: — дидрогестерон (Дуфастон) Непрегнановые производные: — демегестон — промегестон — номегестрола ацетат | Структурно сходные тестостерону Этинилированные Эстрановые производные: — норэтиндрон (Примолют-нор) — норэтинодрел -линестренол — норэтиндрона ацетат — этинодиола диацетат Гонановые производные: — левоноргестрел — дезогестрел — гестоден . — норгестимат Неэтинилированные: — диеногест |
Существует только один природный прогестаген, имеющий биологическое значение и применяемый в клинической практике, — прогестерон.
Обладая способностью связываться только с прогестероновыми рецепторами (табл. 5), этот прогестаген не вызывает множественных системных эффектов в организме женщины, однако применение его больших доз за счет влияния на энзимы, участвующих в метаболизме стероидов (см. рис. 1), обеспечивает антиминералокортикоидное, а также слабое антиандрогенное и глю-кокортикоидное действие (табл. 6).
Наличие в настоящее время микронизированной формы прогестерона (Утрожестан) обеспечивает возможность как перорального, так и вагинального его применения.
Глава 14. Принципы применения половых стероидных гормонов. 261
Таблица 5 Способность разных типов гестагенов взаимодействовать с прогестероновыми андрогенными рецепторами
(Donald P. McDonnell, 2000; Oettel M, Schillinger E., 1999; Yen S.S.C. et al., 1999)
| Прогестаген рецепторы | Прогестероновые рецепторы | Андрогенные |
| Прогестерон | + | — |
| Дидрогестерон | + + | — |
| Медрогестерон | + | — |
| Хлормадинона ацетат | + + | ± |
| Мегестрола ацетат | + + | ± |
| Медроксипрогестерона ацетат | + + | ± |
| Ципротерона ацетат | + | + |
| Демегестон | + + | — |
| Промегестон | + + + | — |
| Номегестрола ацетат | + + + | — |
| Норэтинодрел | + + | + |
| Левоноргестрел | + + + | + + |
| Норгестимат | + | ± |
| 3-кето-дезогестрел | + + + | + |
| Гестоден | + + | + + |
В настоящее время имеется также возможность применения прогестерона трансдермально в виде геля (Прожестожель). Трансдермальное применение прогестерона обеспечивает поступление гормона непосредственно в кровеносное русло, минуя первичный метаболизм в печени. Это очень важно для пациенток с патологией печени и желудочно-кишечного тракта. Однако для достижения в сыворотке крови концентрации гормона, необходимой для лечения большинства патологических состояний, в терапии которых используются прогестагены, необходимо было бы применение достаточно больших доз Про-жестожеля. Именно поэтому наиболее широкое клиническое применение этот препарат получил в лечении ряда дисгормональных заболеваний молочных желез, учитывая наличие локального биосинтеза эстрогенов, что более подробно освещено в разделе, посвященном патологии молочной железы.
Говоря о возможных путях введения прогестагенов,следует отметить, что с точки зрения влияния на эндометрий перспективным является внутри-маточное введение одного из наиболее активных прогестагенов — левонорге-стрела в виде внутриматочной системы (ВМС) «Мирена». При использовании этой системы ежедневно в полость матки высвобождается 20 мг левоноргест-рела, при этом концентрация его в плазме крови составляет 170 пг/мл через неделю использования ВМС и 119 пг/мг — через 1 год (Tapani Luukkainen, 1998). Концентрация же таким образом введенного гормона в эндометрии в 1000 раз превышает его содержание в плазме крови (Савицкий Г.А., Савицкий А.Г., 2000), что обеспечивает достаточную стромальную супрессию эндометрия с минимальным системным воздействием на организм.
2 Эндокринная гинекология
Таблица 6 Спектр гормональных эффектов прогестагенов(Donald P. McDonnell, 2000; Oettel M., Schillinger E„ 1999; Yen S.S.C. et al., 1999)
| Прогестаген | Гормональный эффект | прогесте-роновый | антиглюко-кортикоидный | антиэстро-генный | эстрогенныи | андрогенныи | антиандро-генный | глюкокорти-коидный | антиминера-локортикоидный | вирилизация | феминизация |
| Прогестерон | + | + | + | — | ± | + | + | — | ||
| Дидрогестерон | + | — | + | — | — | ± | — | ± | — | — |
| Производные 19-нортестостерона | ||||||||||
| Норэтистерон | + | + | + | + | + | — | — | + | — | |
| Линестренол | + | + | + | + | + | — | — | — | + | — |
| Норэтинодрел | + | + | + | + | + | — | — | — | ■7 | ? |
| Левоноргестрел | + | + | + | — | + | — | — | — | + | |
| Норгестимат | + | + | + | + | — | — | — | + | — | |
| 3-кето-дезогестрел | + | + | + | + | — | ? | + | — | ||
| Гестоден | + | + | + | — | + | • | + | + | + | — |
| Диеногест | + | + | + | — | — | + | ||||
| Производные гидроксипрогестерона | ||||||||||
| Медрогестон | + | + | + | ± | — | — | — | + | ||
| Хлормадинон ацетат | + | + | + | — | + | + | + | |||
| Ципротерон ацетат | + | + | + | — | + | + | — | + | ||
| Мегестрол ацетат | + | + | + | — | + | + | — | + | ||
| Медроксипрогестерон ацетат | + | + | + | — | + | — | + | + | + | |
| Производные спиронолактона | ||||||||||
| Дроспиренон | + | + | + | — | — | + | — | + | + |
Следует отметить, что содержание левоноргестрела в плазме крови при использовании системы «Мирена» в 100 раз ниже, нежели при использовании соответствующих оральных контрацептивов (Sholten P.S., 1989), чем и обусловлено практическое отсутствие нежелательных системных эффектов этого гестагена. Указанные преимущества локального введения левоноргестрела обеспечивают возможность использования системы «Мирена» у женщин, имеющих противопоказания к применению оральных контрацептивов: сахарный диабет, гипертензия, гиперкоагуляция, возраст более 40 лет, курение и т.д. (Kerstin Andersson, 1998; Sholten P.S., 1989; Tapani Luukkainen, 1998).
Что касается имеющегося на сегодня многообразия синтетических прогестагенов,то классифицируются они по строению исходной стероидной молекулы, из которой их получают (см. табл. 4), и, соответственно, обладают различной способностью связываться с различными рецепторами (см. табл. 5, 6).
Глава 14. Принципы применения половых стероидных гормонов. 263
Первым соединением, синтезированным С. Djerassi et al. (1951), был 17а-этинил-19-нортестостерон (норэтиндрон), который стал родоначальником целого поколения гестагенных 19-норстероидов и обладал некоторыми эстрогенными свойствами.
Следующим открытием стал норгестрел (производное 19-нортестостерона 2-ой генерации), а затем и левоноргестрел, которые являются одними из наиболее сильных норстероидов, активных при пероральном применении и, как уже упоминалось, при локальном введении в полость матки.
Замещение метильной группы у С,,-молекулы норгестрела привело к образованию другого сильного прогестагена 3-ей генерации — дезогестрела, который входит в состав ряда производимых в Европе пероральных контрацептивов.
Не менее интересно получение прогестагенов, структурно связанных с прогестероном. Известно, что прогестерон теряет свою биологическую активность при присоединении гидроксильной группы к С17 в а-положении. Однако образующееся вещество — 17а-гидроксипрогестерон после этери-фикации дает 17а-ацетоксипрогестерон — умеренно активное гестагенное соединение. Оно стало исходным для дальнейшего получения ряда важных веществ. Удлинение алкильной цепи 17а-гидрокси-эфиров позволило получить длительно действующие прогестагены для парентерального применения, такие как 17а-гидроксипрогестерона валерат и 17а-гидроксипрогес-терона капронат. В результате модификации С6-молекулы гидроксипрогесте-рона ацетата синтезированы мощные пероральные гестагены. Один из 6-метил-аналогов — медроксипрогестерона ацетат (Провера, Депо-провера).
Отдельно следует остановиться на неацетилированном прегнановом производном, структурно связанном с прогестероном, — дидрогестероне (Дуфа-стон). Будучи по химической структуре максимально сходным с натуральным прогестероном (рис. 2), этот прогестаген за счет наличия всего одной дополнительной двойной связи обладает большей в сравнении с прогестероном способностью связываться с прогестероновыми рецепторами (см. табл. 5) и оказывать более выраженный прогестагенный эффект при отсутствии влияния на андрогенные и эстрогенные рецепторы. Антиминералокортикоидное действие дидрогестерона обеспечивает стабильность или даже снижение массы тела при применении препарата как в качестве монотерапии, так и в составе комбинированных гормональных препаратов для лечения климактерических нарушений.
Таким образом, многообразие имеющихся на сегодня натуральных и синтетических прогестагенов, как уже отмечалось, требует индивидуального подхода к выбору препарата в каждом конкретном случае
Дифференцированные подходы к применению прогестагенов определяются:
• взаимодействием со специфическими прогестероновыми рецепторами — ПРАиПРВ;
• взаимосвязью с неспецифическими рецепторами — андрогенов, эстрогенов, кортизола, альдостерона;
2*64 Эндокринная гинекология
• влиянием на энзимы, участвующие в метаболизме стероидов, — сульфа-таза, ЗР-гидростероид дегидрогеназа, 17Р-гидростероид дегидрогеназа, 5а-редуктаза, ароматаза, каталаза, сульфотрансфераза.
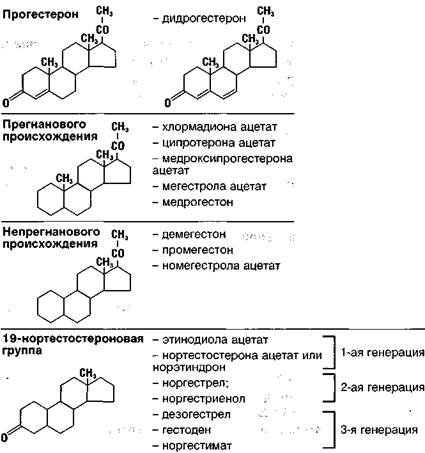
Рисунок 2. Прогестерон и его производные(Genazzani A.R. et al., 1996)
При определении способности взаимодействия с рецепторами половых стероидных гормонов следует учитывать рассматриваемые субтипы как про-гестероновых, так и эстрогенных рецепторов (рис. 3).
Что касается рецепторов прогестерона, то выявлено, что рецепторы В (ПРВ), в отличие от рецепторов А (ПРА), содержат дополнительно 164 аминокислоты. В то же время идентификация субтипов А и В на сегодняшнем этапе развития медицинской науки не имеет существенного клинического значения, ибо не определена их экспрессия в различных органах и системах женского организма, в том числе и в различных отделах репродуктивной системы. Однако именно превалированием того или иного подтипа рецепторов к прогестерону в эндо-или миометрии пытаются объяснить различную динамику фиброматозных узлов при беременности — одни узлы увеличиваются в размерах, другие,
Глава 14. Принципы применения половых стероидных гормонов. 265
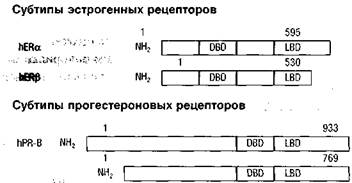 hPR-A Рисунок 3. Субчипы рецепторов эстрогенов и прогестерона(Donald P. McDonnell, 2000)
hPR-A Рисунок 3. Субчипы рецепторов эстрогенов и прогестерона(Donald P. McDonnell, 2000)
наоборот, — уменьшаются (Yen S.S.С. et al., 1999). Кроме того, доказано, что ПРВ действует как активатор транскрипции гена, кодирующего прогестероно-вый ответ, а ПРА — как ингибитор всех стероидных гормонов и минералокор-тикоидов, т.е. стимуляция ПРВ обеспечивает прогестероновое воздействие, а взаимодействие с ПРА приводит к антиэстрогенному, антиминералокортикоид-ному и антипрогестероновому эффекту, что и имеет место при использовании мефипристона — Ru486 (Yen S.S.C. et al., 1999).
Отличия же в экспрессии субтипов эстрогенных рецепторов в различных органах и системах (табл. 7), а также способность разных видов синтетических
Таблица 7 Экспрессия эстрогенных рецепторов аир в различных органах и системах
| Эстрогенные рецепторы а |
| Вентромедиальные и аркуатные ядра гипоталамуса Гипофиз ‘• Печень Почки Надпочечники Костный мозг Макрофаги С08-Т-лимфоциты (супрессоры) В-лимфоциты |
| Эстрогенные рецепторы P |
| Супраоптические и паравентрикулярные ядра гипоталамуса Кора головного мозга Мозжечок Легкие Кишечник ■’ Мочевой пузырь Лимфоидная ткань -■.-.■■ Жировая ткань |
| Эстрогенные рецепторы ар |
| Яичники Матка (больше а) Тимус (больше |3) •- Молочные железы (больше а) Кости (больше P) — в остеобластах а, в трабекулярной кости больше P, в кортикальной — больше а |
прогестагенов оказывать стимулирующее воздействие на эти рецепторы (рис. 4) обеспечивают возможность дифференцированного подхода к выбору вида гормональных препаратов, в том числе и контрацептивов, особенно у пациенток с экстрагенитальной патологией и высоким онкориском.
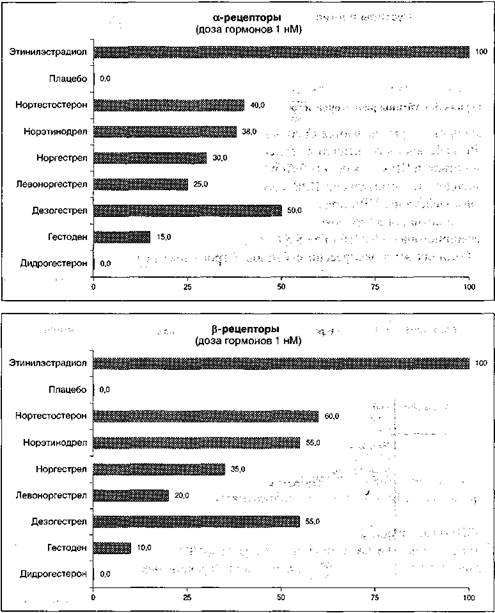
Рисунок 4. Стимуляция эстрогенных а- и Р-реценторов синтетическими нрогестагенами (в качестве эталона — 100% приведен этинилэстрадиол как самый биологически активный синтетический эстроген)(Oettel M., Schillinger Ь., 199VJ
Глава 14. Принципы применения половых стероидных гормонов. 267
Как известно, дифференцированный подход к применению медикаментозных средств в клинической практике предопределяет достижение максимального эффекта в лечении тех или иных патологических состояний при минимальном нежелательном системном воздействии медикаментов на организм, т.е. определение оптимальной дозы и режима введения оптимального в каждом конкретном случае препарата.
Выше упоминалось, что наиболее частым показанием к назначению прогес-тагенов являются гиперпластические процессы эндометрия, а также профилактика гиперпролиферации эндометрия при проведении эстроген-заместительной терапии.
Доказано, что фармакологические свойства прогестагенов, направленные на подавление митотической активности эндометрия, обеспечиваются за счет:
• стромальной супрессии эндометрия;
• снижения активности эстрогенных рецепторов на ядерной мембране;
• увеличения продукции эстрадиол-конвертирующих энзимов, учитывая максимальную биологическую активность эстрадиола (рис. 5); ; -. :
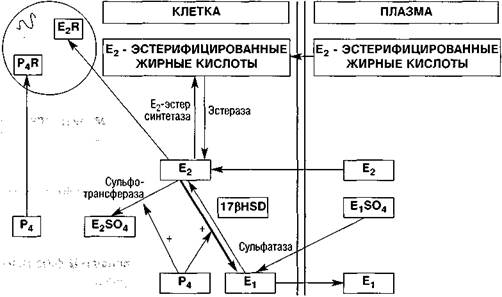
Рисунок 5. Схема действия прогестерона на метаболизм эстрогенов в эндометрии
• угнетения инкорпорации тимидина клетками эндо- и миометрия и сни
жения их чувствительности к эстрогенам;
# угнетения матричных металлопротеиназ — ферментов, обеспечиваю
щих процессы ремоделирования в тканях с физиологическим отторжением —
в эндометрии (особенно важно для предупреждения гетеротопической им
плантации эндометрия в комплексе профилактики и лечения эндометриоза).
M8 Эндокринная гинекология
Резкими исхемы примененияразличных прогестагенов определяются биологическими эффектами различных доз препаратов (табл. 8), данными о чувствительности к прогестагенам эпителия и стромы эндометрия в различные фазы менструального цикла (табл. 9) и, соответственно, той целью, которую ставит перед собой клиницист, назначая лечение того или иного патологического состояния с учетом его патогенеза.
Таблица 8 Дозы прогестагенов, обеспечивающие различные биологические эффекты в эндометрии
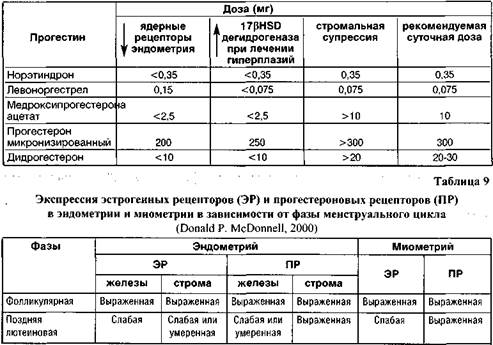
Как следует из данных, представленных в таблице 9, в лечении бесплодия при недостаточности лютеиновой фазы менструального цикла, а также в качестве оппозиции эстрогенам при ЗГТ следует назначать, например, 200 мг микронизированного прогестерона или 10 мг дидрогестерона во II фазе менструального цикла (т.е. с 15-го по 25-й день), а при гиперпластических процессах эндометрия, миоме и эндометриозе — по 20-30 мг дидрогестерона с 5-го по 25-й день менструального цикла для достижения стромальной супрессии эндометрия, учитывая более высокую чувствительность стромы к геста-генам именно в фолликулиновую фазу менструального цикла.
Вышеизложенными механизмами местного и системного действия различных прогестагенов можно объяснить те сложности, с которыми сталкиваются гинекологи в терапии особенно гиперпролиферативных процессов, а также те проблемы, которые возникают перед врачом-интернистом при лечении экс-трагенитальных заболеваний у женщин, применяющих прогестагены по назначению гинеколога.
Глава 14. Принципы применения половых стероидных гормонов. 269
В этой связи следует более детально остановиться на синдроме непереносимости гестагенов, который представляет собой комплекс неблагоприятных эффектов, обусловленный системным действием различных про-гестагенов на организм женщины (табл. 10).
Симптомокомлексы, составляющие синдром непереносимости прогестагенов
| Психопатологический | Метаболический | Физикальный |
| . беспокойство . раздражительность ♦ агрессия ♦ приступы паники ♦ неугомонность ♦ депрессивное настроение . нарушение концентрации . забывчивость ♦ эмоциональная «‘■ ‘ лабильность -.—.v ■.» ,: ♦ вялость | ♦ избыток массы тела с перераспределением жировой ткани ♦ нарушение карбогидратного метаболизма (инсулин- резистентность) ♦увеличение сосудистой резистентности ♦ нарушение липидного обмена (повышение индекса атерогенности) | ♦ акне ♦ себорея ♦ вздутие живота ♦ отеки ♦ слабость ♦ головные боли ♦ головокружение ♦ напряжение в груди |
Метаболические побочные эффекты прогестагенов отмечаются, как правило, при длительном применении высоких доз препаратов, и механизмы их развития в настоящее время окончательно не изучены.
Предупреждение упомянутых эффектов особенно важно в лечении пациенток с нарушением липидного обмена, инсулинонезависимым сахарным диабетом, ожирением или повышенным риском развития этих состояний. Для данного контингента исключительное значение имеет выбор оптимальной дозы и длительности лечения с учетом вышеуказанных принципов, а также выбор типа прогестагенов. Так, клиническими исследованиями доказано отсутствие какого-либо влияния на липидный метаболизм дидрогестерона (Дуфастона) в дозе до 30 мг в сутки, а также индифферентность в отношении карбогидратного метаболизма 30 мг дидрогестерона и 10 мг норэтистерона при длительном применении.
Физикалъные побочные эффекты прогестагенов обусловлены их андро-генным действием за счет связывания с андрогенными рецепторами (см. табл. 5) — это, чаще всего, акне, себорея, алопеция, а также за счет мине-ралокортикоидного эффекта, обусловленного особенностями метаболизма прогестагенов (см. рис. 1) — это, в первую очередь, отеки, прибавка веса, вздутие живота, мигрень. В таких случаях рекомендуется подбор препаратов с учетом их возможных системных эффектов (см. табл. 5) — применение прогестагенов, обладающих антиминералокортикоидным действием (дроспире-нон, дидрогестерон), а также не обладающих андрогенным влиянием (дезоге-стрел, гестоден, дидрогестерон) или обеспечивающих антиандрогенное воздействие на организм (ципротерона ацетат, диеногест).
Развитие психопатологической составляющей синдрома непереносимости гестагенов обусловлено особенностями их метаболизма в ЦНС. В результате
27й — Эндокринная гинекология
обмена ряда синтетических прогестагенов образуются прегнанолон и прегна-нолона сульфат, являющиеся антагонистами ГАМК-рецепторов, т.е. блокирующие как А, так и В ГАМК-рецепторы. Наличие ГАМК В-рецепторов не только в ЦНС, но и в других органах и системах может в некоторой степени объяснить полиморфизм клинических проявлений синдрома непереносимости прогестагенов.
Кроме воздействия на рецепторы ГАМК, прегнанолон воздействует на моноамины, повышая активность моноаминоксидазы и катехол-О-метилтранс-феразы, т.е. ферментов, инактивирующих катехоламин (норадреналин, адреналин и дофамин) и индоламины (серотонин), а также увеличивает обратный захват серотонина. Этим объясняются депрессивные состояния, развивающиеся на фоне применения ряда синтетических прогестагенов.
В таких случаях целесообразно отдавать предпочтение применению натурального прогестерона, который метаболизируется в аллопрегнанолон и обеспечивает мягкий седативный эффект (при отсутствии нарушений метаболизма стероидов в ЦНС), или дидрогестерона,действия метаболитов которого на ЦНС не отмечено.
Таким образом, определяя режим, схему и вид прогестагенов в лечении гинекологических заболеваний, клиницисту следует учитывать особенности местного и системного воздействия назначаемого препарата и руководствоваться современными принципами применения гормональных препаратов в лечении дисгормональной патологии:
• селективность и детерминированный короткий период действия назначаемых препаратов;
• высокая компетентность врача в данной проблеме;
• комплаентность терапии, состоящая в адекватной образованности пациентки и предпочтительном использовании препаратов, удобных в применении.
1.Манухин И.Б., Тумилович Jl.Г., Геворкян M.А. Клинические лекции по гинекологической эндокринологии. — M.: Мед. информ. агентство, 2001. — 247 с.
2. Савицкий Г.А., Савицкий А.Г. Миома матки. Проблемы патогенеза и патогенетической терапи. — С.-Петербург, 2000. — 235 с.
3. Alien E, Daisy EA. An ovarian hormone Preliminary report on its localization, extraction, and partial purification, and action in test animals. JA MA 1923; 81: 819.
4. Butenandt A, Westphal V. Zur Isolierung und Charaktensierung des Corpus-luteum-Hormons Berl. Dtsch. Chem. Ges 1934; 67: 1440.
5. Djerassi C, Miramontes Г, Rozenkranz G. 17a-ethynyl-19-nortosterone. Am. Chemical Society Meeting 1952, Absract 18J.
6. Donald P. McDonnell. Molecular pharmacology of estrogen and progesterone receptors. Menopause Biology and Pathobiology. San Diego-Tokyo: Academic press 2000.
Глава 14. Принципы применения половых стероидных гормонов. 271
7. Eeva-Marja Rutanen. Endometrial response to intrauterine release of levonorgestrel. Gynecology Forum 1998; 3, 3: 11-14.
8. Kerstin Andersson. Intrauterine release of levonorgestrel- a contraceptive and therapeutical system. Gynecology Forum 1998; 3, 3: 3-5.
9. Oettel M, Schillinger E. Estrogens and antiestrogens J. Berlin: Springer 1999: 407.
10. Sholten PS. Treatment of menorrhagia by intrauterine administration of levonorgestrel. Utrecht Univercity Hospital 1989. Thesis: 47-51.
11. Tapani Luukkainen. Development of the levonorgestrel- releasing intrauterine system. Gynecology Forum 1998; 3, 3: 6-8.